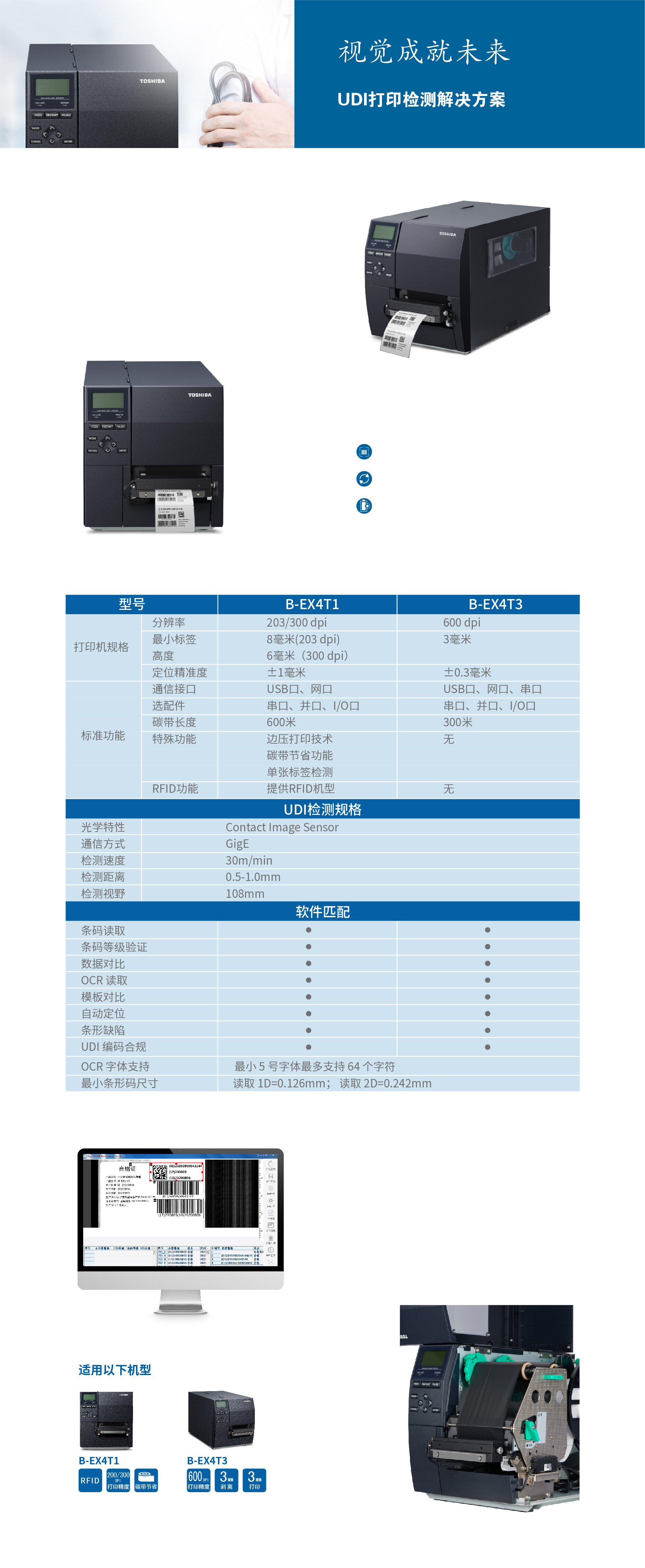
医疗器械唯一标识系统
▪
2019 年国家药监局制定了《医疗器械唯一标识系统规则》,并于 2019年 10月 1 日起施行。规定中明确了注册人/备案人应选择与其创建的医疗器械唯一标识(UDI)相适应的数据载体标准,并对以其名义上市的医疗器械的各种销售单元、各级别包装或者医疗器械产品上赋予唯一标识(UDI)数据载体,并确保在医疗器械经营使用期间唯一标识(UDI)数据载体牢固、清晰、可读。
检测性能优越
可对单张或批量UDI标签进行实时打印和检测。
可对UDI标签的条码等级和质量进行验证。
可以对UDI标签的编码合规性进行验证。
计算机配置要求
六代CPU处理器 64位
内存8G以上
网口与CIS建立数据通信
软件运行必须与USBKey链接
内存8G以上
网口与CIS建立数据通信
软件运行必须与USBKey链接